分化型甲状腺癌(DTC)是甲状腺癌中最常见的病理类型。因为肿瘤细胞还部分保留了正常甲状腺细胞的分化功能,因此DTC细胞可分泌甲状腺球蛋白(Tg),并可表达钠碘协同转运体(NIS)和促甲状腺激素(TSH)受体。DTC细胞的这种特征,是DTC术后可应用Tg作为监测指标,以及施行放射性碘治疗和TSH抑制治疗的基础。 自上世纪30年代外科医生以病例报告和病例系列形式提出DTC术后TSH抑制治疗以来,多个学科的学者们持续开展研究和总结,帮助我们对这一治疗方式的原理、作用、目标和副作用等方面不断增进认识。当前已经达成的共识指出:TSH抑制治疗的临床实践应该以患者为中心、以风险分层(初始复发风险分层、疗效反应分层和TSH抑制治疗副作用风险分层)为基础、制订个体化目标和用药方案。 甲状腺全/近全切除术曾一度是治疗DTC的标准术式。但是,由于多数DTC肿瘤生物学特性相对温和、进展缓慢,结合现代DTC的新特点如筛查发现者增多和低危癌比例攀升等,采用甲状腺腺叶(±峡部)切除术作为初始手术治疗术式的DTC患者越来越多。这个新形势带来了新问题——DTC腺叶切除术后,TSH抑制治疗如何实施?针对这一问题,本文特邀广东省人民医院内分泌科王龙医生和关海霞医生展开细致解读,现将内容整理如下。 王龙 主治医师 广东省人民医院 内分泌科主治医师 擅长各种甲状腺疾病诊疗和微创消融治疗 中国医师协会介入医师分会超声介入专业委员会委员 广东省健康管理学会甲状腺病学专业委员会委员 关海霞 主任医师 广东省人民医院 主任医师、博士生导师 广东省人民医院大内科副主任兼内分泌科副主任 擅长甲状腺疾病、肿瘤相关内分泌代谢紊乱等的诊治 中华医学会内分泌学分会青委会副主委 中国抗癌协会甲状腺癌专委会常委 Thyroid 和 Endocrine 杂志副主编 DTC腺叶切除术后TSH抑制目标的设定依据是什么?
在回答这个问题前,首先要厘清一个理念——腺叶切除术并非仅是低危DTC的专利。一方面,受限于术前淋巴结评估的精确性,部分术前判定为低危DTC而行腺叶切除术的DTC患者,根据术后病理最终被判定为复发风险中高危;另一方面,出于最大程度上避免过度治疗的探索,非全切术式也被用于经过仔细择选的部分复发风险中危患者,如一侧腺叶原发灶T1/T2期伴同侧侧方淋巴结转移者且无其他危险因素。因此,尽管都是腺叶切除术后的DTC患者,但其肿瘤复发风险却可能分属于不同的分层。
因此,我们必须明确:对腺叶切除术后的DTC患者,制订TSH抑制治疗目标的依据不是术式,而是仍要基于肿瘤特征(初始复发风险和对治疗的反应)和个体特征(亚临床甲状腺毒症致不良反应的风险)来考量。
对DTC腺叶切除术后的TSH抑制目标,指南如何推荐?
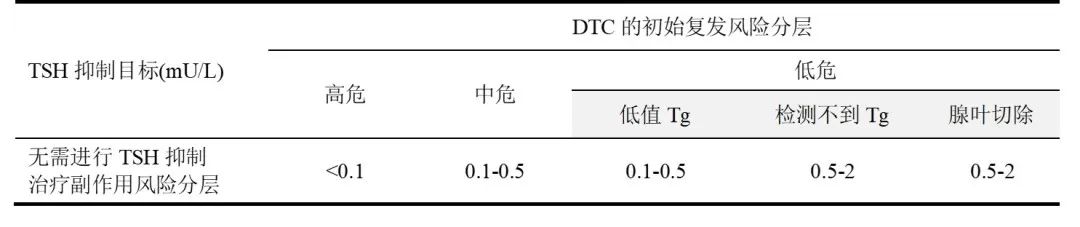
在2022年中国抗癌协会发布的《中国肿瘤整合诊治指南-甲状腺癌》(下简称CACA指南)中,有关TSH抑制治疗目标的推荐意见如表1和2所示。由此可见,对腺叶切除术后的DTC患者,根据术后临床病理特征确定初始复发风险分层后,在初治期内宜以高危组<0.1 mU/L、中危组0.1-0.5 mU/L、低危组0.5-2.0 mU/L作为抑制治疗目标;而在随访期,则根据疗效反应和抑制治疗副作用风险确定TSH目标,除非有明确生化或结构复发证据,绝大多数患者的抑制目标在0.1-2.0 mU/L范围内。在CACA指南对TSH抑制治疗目标的进一步解读中,还对抑制治疗的时长给出建议——初始复发风险为低危的DTC患者,如果治疗疗效满意,持续5-10年TSH抑制治疗后,可转为甲状腺激素替代治疗,即TSH不超过正常上限即可;初始复发风险为高危的DTC患者,如果治疗疗效满意,可将TSH控制于0.1-0.5 mU/L持续5年,再按照表2调整TSH抑制治疗目标。
表1 DTC术后初治期(手术±131I治疗后1年内)的TSH抑制治疗目标

表2 DTC术后随访期(手术±131I治疗1年后)的TSH抑制治疗目标

注:
* 表格中的0.5(mU/L),代表TSH的参考范围下限,根据检测试剂盒的具体情况可为0.3~0.5(mU/L)。
** TSH抑制治疗的副作用风险:低风险——绝经、心动过速、骨量减少;中风险——年龄>60岁、骨质疏松;高风险——房颤。抑制治疗副作用风险较高者,应在可耐受的情况下,尽量接近或达到TSH抑制治疗目标。
***初始复发风险为低危的DTC患者,如果治疗疗效满意,持续5-10年TSH抑制治疗后,可转为甲状腺激素替代治疗,即TSH不超过正常上限即可;初始复发风险为高危的DTC患者,如果治疗疗效满意,可将TSH控制于0.1-0.5 mU/L持续5年,再按照本表格调整TSH抑制治疗目标。
腺叶切除术后的DTC患者,实施TSH抑制治疗时应注意哪些问题?
第一,由于这类DTC患者术后仍留有一侧腺叶的甲状腺组织,如果其自身能够产生足够量的甲状腺激素,将TSH维持于患者的抑制治疗目标内,则无需加用外源性甲状腺激素。研究显示,这种无需外源用药即可TSH达标的情况多见于同时具备下述特征的患者:① 因DTC为低危复发风险而仅需将TSH控制于正常范围下半程(<2mU/L);② 腺叶切除术前TSH <2mU/L;③ 无合并自身免疫性甲状腺炎的血清学和病理学证据。因此,如果在腺叶切除术后经验性处方左甲状腺素(LT4),需注意部分患者可能出现抑制过度,要有监测甲功和适时减量、停药的意识;也可以在符合三条特征的患者术后,暂不立即给予LT4,观察1-3个月后根据TSH水平决定后续用药方案。
第二,为达到同样的TSH抑制目标,腺叶切除术后患者的LT4用量通常低于同体型的全切术后患者。因此,治疗起始时LT4剂量应低于全切术后估算用药量(1.6-2.2微克/公斤体重·天)。
第三,腺叶切除术后,剩余腺叶组织自身产生甲状腺激素的能力、是否发生自身免疫炎症破坏等,可能带来循环中甲状腺激素水平波动,进而导致TSH检测结果波动。例如:DTC腺叶切除术后、伴有桥本甲状腺炎的女性,产后1年内剩余腺叶可能发生产后甲状腺炎;典型产后甲状腺炎先出现甲状腺滤泡破坏导致甲状腺激素漏出,漏出的激素代谢殆尽后甲状腺功能减退,然后逐渐恢复至产前甲状腺功能状态。在这样一个甲状腺炎的病程中,内源性甲状腺激素的变化必然会影响TSH水平和外源性LT4剂量。因此,腺叶切除术后患者如遇LT4未变动而TSH波动者,要考虑到上述因素,监测随访或酌情调整药物剂量。
第四,低危腺叶切除术后患者TSH目标为0.5-2.0mU/L时,究竟靠近0.5还是2.0mU/L,可根据患者年龄、妊娠计划、TSH抑制治疗副作用风险、病理资料的完备程度(如淋巴结情况等是否仔细评估)、是否合并其他未列入复发风险评估标准的特征(如甲状腺被膜受累但未造成腺外侵袭)等综合分析。例如:年轻、TSH抑制治疗副作用风险低、淋巴结虽无转移但清扫数量少、有甲状腺被膜受累时,可考虑靠近0.5mU/L一侧。
第五,对于TSH抑制治疗理念和目标的认识,近年来的发展和变化较快。例如,根据近期文献证据,复发风险高危DTC患者术后TSH抑制至 <0.1 mU/L时,无病生存率显著提高,而进一步抑制到<0.03 mU/L时获益不再增加,反而可能诱发TSH抑制治疗相关的不良事件,因此即便高危患者,TSH也已不是越低越好。因此,我们要关注TSH抑制治疗领域中的进展,肯于接纳新证据,肯于改变旧观念,为患者提供最佳的医疗建议。
参考文献:
1.关海霞. 中华内科杂志 2014, 53: 694.
2.Wang Z, et al. Endocr Pract 2020, 26: 1085.
3.Song J, et al. World J Surg 2020, 44: 2677.
4.《中国肿瘤整合诊治指南-甲状腺癌》(2022版)
5.Wang Z, et al. Ann Transl Med 2020, 8:1238.
6.Diessl S, et al. Clin Endocrinol (Oxf) 2012, 76: 586.